AI醫療影像助急診科快速檢出顱內出血(CADt)
作者
謝世良簡介
謝世良特聘研究員現任職於中央研究院基因體研究中心,曾榮獲國科會三次傑出研究獎、教育部學術獎、李天德及王明寧傑出貢獻獎,及教育部國家講座教授。
單位
中央研究院文章來源
https://www.nature.com/articles/s41467-019-10360-4 https://www.frontiersin.org/articles/10.3389/fimmu.2019.02867/full-
標籤
-
分享文章
基於國際授權條款4.0,您可免費分享此篇文章
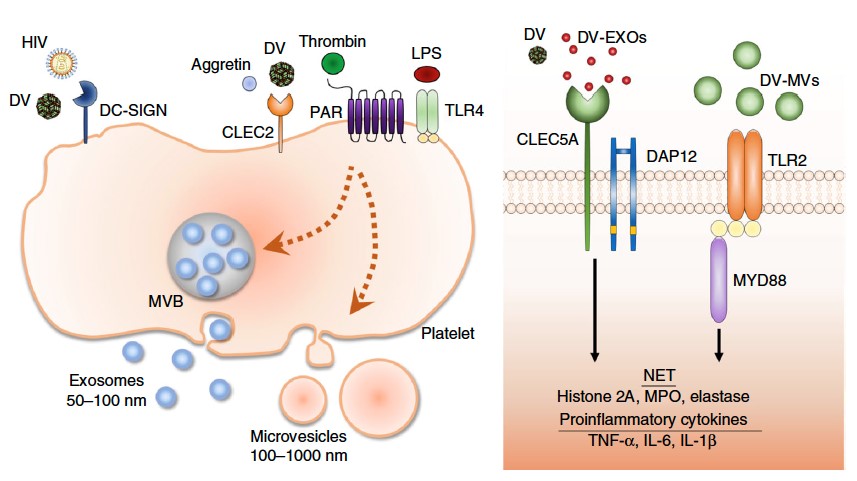
急性病毒感染通常因為受感染的細胞以及白血球釋放大量細胞激素及趨化因子而引起細胞激素風暴。胞內體中類鐸受體及胞質核酸感應器的保護作用已經有完整闡明,但病毒感染期間,致病宿主的因素並不清楚。脾酪氨酸激酶(Syk)偶聯的C型凝集素(CLEC)CLEC2和CLEC5A分別大量表現在血小板還有骨髓細胞。CLEC2已經被證實會辨認蛇毒蛋白aggretin 以及內源性配體podoplanin ,且作為免疫血栓產生的重要調控者。我們最近證實CLEC2及CLEC5A對於病原體引起之「嗜中性白血球胞外捕捉」以及前發炎細胞激素產生非常重要。此外,登革病毒以及流感病毒引起CLEC2活化產生夠引起胞外囊體釋放,經由CLEC5A及TLR2引起嗜中性白血球胞外捕捉以及前發炎細胞激素。這些發現不僅闡明胞外囊體在血小板-白血球交互作用的免疫調節功能,也證實CLEC2和CLEC5A在急性病毒感染中的重要角色。利用雙特異性抗體阻斷CLEC5A和TLR2,有望於未來用於抑制病毒引起細胞激素風暴。
2003年,全球爆發嚴重急性呼吸系統綜合症冠狀病毒(severe acute respiratory syndrome coronavirus, SARS-CoV)感染,激起了我們對於細胞激素風暴的探索,細胞激素風暴即病毒感染後通過宿主免疫系統激活大量細胞因子而過度產生,細胞激素風暴會引起嚴重的發炎反應,並且在感染後2-5天引起全身性血管通透性增加。SARS-CoV和其他急性病毒感染的共同特徵,為其在後天免疫系統完全活化前,早期發炎反應會引發局部或全身血管通透性升高。這些觀察顯示,先天免疫反應在急性病毒感染致病機轉中扮演重要角色。
急性病毒感染共同症狀在暴露於病毒後發炎反應迅速產生,臨床症狀從不明顯及輕度發燒,到嚴重炎症以及主要器官血管通透性增加。人類的嚴重急性感染通常是胞膜病毒所引起,像是登革病毒(黃病毒科)、屈公病毒(披膜病毒科)、SARS-CoV(冠狀病毒)、流感病毒(正黏液病毒科)、麻疹病毒(副黏液病毒科)、狂犬病毒(炮彈病毒科)、漢他病毒(本雅病毒目)、伊波拉病毒和馬堡病毒(絲狀病毒科)。這表示膜的成分可能引起嚴重發炎反應。
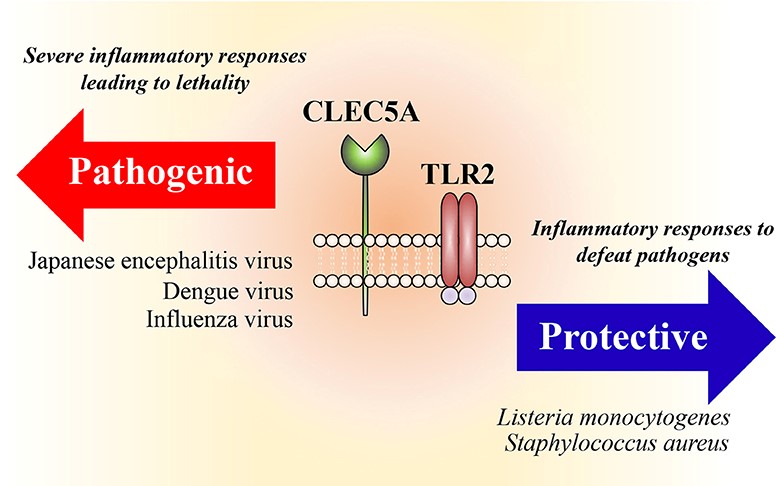
胞內體中類鐸受體及胞質核酸感應器的保護作用已經有完整闡明,但病毒感染期間,致病宿主的因素並不清楚。脾酪氨酸激酶(Syk)偶聯的C型凝集素(CLEC)CLEC2和CLEC5A分別大量表現在血小板還有骨髓細胞。CLEC5A負責登革病毒引起的出血熱及休克症狀,這些症狀為登革病毒感染嚴重反應,特徵是由於全身血管通透性增加引起血漿滲漏。阻斷登革病毒以及CLEC5A交互作用抑制了前發炎細胞激素的分泌,但是並不影響干擾素α的產生。最近,我們發現CLEC2作為登革病毒的嶄新模式識別受體,登革病毒感染活化血小板表現CD62p、CD63及釋放胞外囊體,包括微泡和胞外體。然而,為活化血小板釋放之胞外體和微泡並沒有活性,而登革病毒引起之胞外體和微泡是「內源性危險訊號」,分別能夠引起CLEC5A及TLR2的活化,促進嗜中性白血球產生嗜中性白血球胞外捕捉以及巨噬細胞釋放前發炎細胞激素。此外,阻斷CLEC5A提供了30%的保護率,同時阻斷CLEC5A及TLR2更進一步提高小鼠存活率至90%。這些觀察指出,CLEC5A/TLR2不僅對於登革病毒引起之致病機轉非常重要,對於經由辨認血小板釋出胞外體和微泡在血小板-白血球交互作用中也非常重要。因此,將CLEC5A/TLR2作為標靶,治療急性病毒感染,實為具潛力的嶄新治療策略。
訂閱電子報以獲得最新資訊
填寫連絡資訊以取得每月發行之電子報




